2015 yılı Nobel Kimya Ödülü’ne “DNA Onarımı” alanındaki araştırmaları nedeniyle DNA Francis Crick Enstitüsü ve Clare Hall Laboratuvarı (Hertfordshire, İngiltere) öğretim üyesi Profesör Thomas Lindhal, Duke Üniversitesi Tıp Fakultesi ve Howard Huges Tıp Enstitüsü (Durham, North Carolina, A.B.D) öğretim üyesi Profesör Paul Modrich ile North Carolina Üniversitesi (Chapel Hill, N.C., A. B. Devletleri) öğretim üyesi Profesör Aziz Sancar layık görülmüştür (Şekil-1a ve 1b). Profesör Aziz Sancar DNA onarımında nukleotid kesip-çıkarma mekanizmasını tanımlayarak bu konuda önemli buluşlara imza atan çok değerli bir Türk bilim insanıdır. DNA onarımı mekanizmaları alanında yapılan bu buluşlar kanserin patolojisinin daha iyi anlaşılması ve yeni tedaviler geliştirilmesi açısından çok önemlidir.
Günümüzde kanser, hücrelerimizin görevlerini, büyüme ve bölünmelerini kontrol eden genlerdeki değişiklikler sonucu ortaya çıkan bir hastalık olarak kabul edilmektedir. Kanser hastalığına yol açan genetik değişiklikler aileden, anne ve babadan alınan genlerle bir araya gelerek gelişebileceği gibi yaşam boyunca ortaya çıkan istenmeyen gen değişiklikleri (mutasyonlar) sonucu da olabilmektedir. Kanser gelişiminde normal hücre biyolojisinde yer alan büyüme, bölünme, çoğalma, olgunlaşma ve ölüm (apoptozis) süreçlerindeki değişikliklerin çok önemli rolleri bulunmaktadır. Örneğin, tütünün içinde bulunan katrandaki 4500’den fazla kansere yol açan kimyasal madde (karsinojenler), radyasyon, ve güneş ışığı (ultraviolet) gibi çevresel faktörler hücre biyolojisinde istenmeyen etkilere neden olabilmektedirler.
Son yıllardaki araştırmalar, bir hastada ortaya çıkan kanserin başka bir bireydeki aynı tür kanser ile genetik değişiklikler yönünden farklılıklar gösterdiğini ortaya koymuştur. Hatta aynı tümör dokusu içinde bile çok farklı hücrelerin farklı genetik kombinasyonları taşımasının mümkün olduğu gösterilmiştir. Bu bulgular kanser dokusundaki hücrelerin farklılıklarını (heterojenitesi), tanı ve tedavi zorluklarını gündeme getirmesi yönünden çok önemlidir.
Kansere yol açan genler genelde üç temel grupta toplanmaktadır; proto-onkogenler, tümör supresör genler ve DNA tamiri genleri. Bu genlere “driver= olayı idare eden” genler adı da verilmektedir. Proto-onkogenler normal hücre büyümesi, hücre bölünmesi ve hücre-içi sinyallerden sorumludurlar. Ancak, bu genler değişik etkiler altında olumsuz yönde değişecek olurlarsa “onkogen = kanser geni” özelliği kazanırlar ve sonuçta hücrelerin büyümeleri ile yaşam süreçleri düzensiz bir sürece geçerler. Kontrolsüz büyüme, çoğalma, farklılaşma ve matürasyon sürecinin bloklanması ile yaşam sürelerinin uzaması (apoptozis yokluğu) ve yayılma (metastaz) sonucu hücrelerinin oluşturduğu doku kanser niteliği kazanmaktadır (Tablo 1). Tümör supresör genler (p53 gibi) de hücrelerin büyüme ve bölünmelerini kontrol eder. Tümör supresör genlerde meydana gelebilecek değişiklikler, bu genlerin onkogenler üzerindeki supresör etkilerinin ortadan kalkmasına yol açar. Ayrıca, zedelenmiş veya zarar görmüş DNA’nın tamirinde rol oynayan DNA onarım genlerindeki mutasyonlar da diğer genlerde yeni mutasyonların ortaya çıkmasına neden olabilirler.
DNA’nın Temel Yapısı ve Mutasyonlar
Hücre her bölünmesinde genomik bilgiyi taşıyan DNA’yı kopyalayarak iki katına çıkarır. DNA’nın kopyalanmasına ‘replikasyon’ denir ve bu kopyalama işlemi karmaşık enzimatik reaksiyonları içerir ve hücre yaşamı için genomik DNA’nın doğru bir şekilde kopyalanması çok önemlidir. Çift sarmal yapıda olan DNA sentez esnasında, replikasyon çatalı denilen belli bölgelerden açılır ve atasal ipliğe eşlenik yeni tamamlayıcı yeni iplik sentezlenir. Fosfatlanmış şeker moleküllerinden oluşan dış iskelete bağlı bulunan ve dört farklı deoksirobonukleoik asit bazlarından (sitozin-C-, timin-T -, adenine- A- ve guanin-G-) oluşan her bir DNA ipliği eşlenik ipliği ile bazlar arasındaki hidrojen bağları kurarak çift sarmal yapıyı oluşturmaktadır (Şekil 2). DNA’nın üç boyutlu polimer yapısı 1953 yılında Watson ve Crick tarafından belirlenmiştir. Watson ve Crick’in DNA modelindeki ana nokta çift sarmal yapısındaki baz eşleşmelerinde A’nın T ile ve G ‘nin C ile hidrojen bağları kurmasıdır. Yeni sentezlenen DNA ipliğine deoksiribonukleozid trifosfatlar (dNTP’ler) eklenmesi DNA polimeraz enzimi tarafından gerçekleşir.
Mutasyon oranı hesapları, DNA polimeraz enziminin hata frekansını 109-1010 baz eklenmesinde bir yanlış baz olarak saptamaktadır. Mutasyon sıklığının bu kadar düşük olmasının sebepleri; 1) yanlış eşleşen bazlar arasında serbest enerji değişikliğinin doğru baz eşleşmesini destekleyecek ölçüde fazla olması, 2) DNA polimerazın doğru baz konformasyonunu ayırt edebilecek yapısı ve 3) DNA polimerazın yanlış eklediği baz’ı düzeltme (proofreading) aktivitesidir.
Mutasyonlar, replikasyon nedeniyle eklenmiş yanlış baz’lar yanı sıra hidrolitik reaksiyonlar, metilasyonlar, oksidatif solunumunun ve çevresel toksinleri içeren redoks döngüsel olaylarının ürünü reaktif oksijen bileşikleri ile de DNA hasarı oluşur. Reaktif oksijen bileşikleri enflamasyon alanlarında bağışıklık sistem hücreleri (makrofajar ve nötrofiller) tarafından da üretilir. Endojen nedenler ile oluşan oksidayon ile DNA hasarı oranı hücre başına yaklaşık 10.000 olarak saptanmıştır. Reaktif oksijen türleri DNA’da baz kaybına, yanlış eşleşmeye veya iplik kırıklarına yol açabilir. Bu hasarların içinde en az oluşanı ama en zor onarılanı çift iplik kırıklarıdır. Çevresel DNA hasar ajanlarından en önemlisi ise ultraviyole ışınlarıdır (UV). Ozon tabakası güneş UV spektrumunun en zararlı kısmını (UV-C) absorbe eder ancak kuvvetli güneş ışığına bir saat maruz kalan her hücrede ozon tabakasından geçen UV-A ve UV-B yaklaşık 100.000 lezyon oluşmasına sebep olur. İyonize radyasyon (IR) da değişik formlarda DNA hasarı oluşturabilir. Bazı IR doğal bulunan radyoaktif bileşiklerden kaynaklanır. Örneğin uranyum radyoaktif radon gazı oluşturarak akciğer kanseri riskinin artmasına yol açmaktadır. Günümüzde kansere sebep olan en önemli çevresel etkenler birisi de sigaradır. Aflatoksin içeren besinler, özellikle şarkuteri ürünlerinde koruyucu olarak kullanılan nitritler, türevleri ve aşırı pişirilmiş et ile açığa çıkan kimyasallar DNA hasarına yol açan diğer önemli dış etkenler arasında sayılabilir.
DNA Onarım Mekanizmaları
DNA’da oluşan hasarlar DNA onarım mekanizmaları ile düzeltilir. DNA onarımında görev alan altı farklı temel mekanizma bilinmektedir: DNA hasarı DNA sentezi (replikasyon) olmadan veya DNA sentezi sırasında farklı yolaklar ile gerçekleşmektedir. Öncelikle mikroorganizmalarda (Eschericia coli) tanımlanmış olan DNA onarım mekanizmaları tüm canlılarda bulunmakta olup, rol oynayan proteinler çok sayıda olup, tüm canlılarda benzerlik göstermektedir (Şekil 3 ve Tablo 2). Bu yolaklarda kendilerine özel çok sayıda protein veya yolaklar arası karşılıklı konuşmayı sağlayan ortak proteinler içermektedir (Tablo 2).
- DNA sentezi (replikasyon) olmadan DNA hasarını onaran yolaklar:
- Direk onarım yolu
- Baz kesip çıkartma yolağı (base excision repair–BER-)
- Nukleotid kesip çıkartma yolağı (nucleotide excision repair-NER)
- Non-homolog rekombinasyon (Non-Homolog End Joining-NHEJ-) ile onarım. Hata yapmaya eğilimli olan NHEJ onarımı çoğalmayan sessiz durumdaki hücrelerde (örneğin erişkin kök hücrelerde) tek iplik kırıklarını düzeltir.
- DNA sentezi sırasında DNA hasarını onaran yolaklar:
- Yanlış eşleşme onarımı mekanizması (mismatch repair-MMR-)
- Homolog rekombinasyonla onarım (HR) çoğalan hücrelerde (örneğin embriyonik kök hücreler) DNA sentezi sırasında eşlenik (komplementer) ipliği kullanarak iplik kırıklarını doğru bir şekilde onarır. DNA’da oluşan çapraz bağların onarılması da HR yolağı ile olmakla birlikte çapraz bağ lezyonlarının tanınıp açılması için FANC proteinlerinin bulunduğu FANC yolağı ile gerçekleşir.
Embriyonik kök hücrelerde hata olasılığı diğer hücrelere göre 100 kat daha az gözlenmektedir. Embriyonik kök hücrelerdeki fazla replikasyon stresine rağmen daha az DNA hasarı görülmesinin sebebi bu hücrelerde özelleşmiş DNA onarım mekanizmaları yanısıra, genotoksik ajanları nötralize edebilen antioksidatif, antialkilleyici enzimler ve de genotoksik ajanları hücre dışına atabilen yüksek miktarda hücresel pompa sistemleri bulunmasıdır.
2015 yılı Nobel Kimya ödülü DNA onarım mekanizmalarında yaptıkları buluşlar nedeni ile üç bilim insanı arasında paylaşıldı. Halen İngiltere Francis Crick Enstitüsü’nde araştırmalarını sürdürmekte olan İsveç asıllı Thomas Lindahl baz kesip çıkarma (Base Excision Repair-BER-) ile onarım mekanizmasındaki enzimleri bulmuştur. BER sistemi oksidasyon, alkillenme, amin, purin veya pirimidin kayıplarına bağlı baz lezyonlarının tamirini yapar. BER onarımı baz lezyonunu tanıyan DNA glikozilaz enzimi ile başlar. Farklı baz hasarlarını tanıyan farklı DNA glikozilaz enzimleri vardır. Uygun DNA glkozilaz enzimi ile tanınan hasarlı baz ortamdan uzaklaştırılarak XRCC1 gibi bir dizi BER proteinleri ile hasar onarılır (bkz. Tablo 2). BER mekanizması DNA’da torsiyona yol açmayan baz lezyonları yanı sıra tek iplik kırıklarının onarımında da rol oynar. BER mekanizması olmadan herhangi bir organizmanın yaşamı mümkün değildir.
Amerika Birleşik Devletleri Howard Hughes Tıp Enstitüsü’nden (Durham, NC) Paul Modrich hücre çoğalırken DNA replikasyonu sırasında nasıl yanlış eşleşmeler olabileceğini ve bu yanlış eşleşmelerin onarılmasında rol oynayan enzimleri bulmuştur. Replikasyondan hemen sonra yeni sentezlenen ipliğin üzerinde prokaryotkarda metil işaretlerinin olmaması, ökaryotlarda ise geçici çentiklerin olması sayesinde yanlış eşleşen ipliği tanıyan enzimlerce DNA hasarı düzeltilir. Yanlış eşleşme onarım (MMR) sisteminde; hMSH2 ve hMSH6’nın oluşturduğu heterodimer protein hMutS ile yanlış eşleşen bölüm tanınır. Daha sonra hMLH1 ve hPMS2’nin oluşturduğu diğer bir heterodimer protein hMutLα ATP’ye bağımlı bir şekilde aktivite göstererek yanlış eşleşen bölgeye bağlanır. Bu bağlanma hMutS’nin yapısal değişimine yol açar ve hMutS DNA üzerine kenetlenerek MutL kompleksini (insanda MLH1 ve hPMS2 proteinlerinden oluşur) DNA üzerine çağırır. MutL kompleksi DNA replikasyon enzimi DNA polimerazın ve ona yardımcı PCNA proteinin DNA üzerinden düşmesine sebep olarak DNA çoğalmasını durdurur. Daha sonra, yeni sentezlenen yanlış DNA ipliği ekzonukleaz (EXO1) enzimi ile yıkılır.
Amerika Birleşik Devletleri North Carolina Üniversitesi Biyokimya ve Biyofizik anabilim dalı öğretim üyesi Türk bilim insanı Prof. Dr. Aziz Sancar ise UV ve diğer mutajenler ile olan DNA hasarları üzerine E. coli bakterisinde yaptığı çalışmalarında nukleotid kesip çıkarma mekanizmasını (NER) tanımlamıştır. Daha sonra bu mekanizmada rol oynayan enzimleri kodlayan genlerdeki mutasyonların kansere yatkınlığı artırdığı gösterilmiştir. DNA kopyalanması (replikasyon) ve gen ifadesi (transkripsiyon) esnasında oluşan torsiyonel lezyonlarını düzelten global NER ve transkipsiyonel NER yolakları olarak tanımlanmış farklı yolaklar mevcuttur. Global NER sisteminde; E.coli’de UvrA ve B eukaryotlarda XPA, XP-C ve 28B proteinleri DNA’da oluşan hasar sonucu (örneğin UV’ye maruz kalma sonucu DNA’da yanyana yerleşmiş olan Timin’lerin dimerleşmesi) baz eşleşmemesine bağlı balonlaşmayı ve DNA torsiyonunu tanır. XP-C’nin hasarlı bölgeye bağlanması TFIIH bölgeye getirerek 25 nukleotidlik bir çift iplik açılmasını sağlar. Tek iplik bağlayıcı proteinler olan RPA’lar ile açılan ipliğin tekrar kapanmaması sağlanır. XP-F, ERCC1 ile heterodimer yapar ve XP-G endonukleazı ile birlikte (prokaryotlarda UvrC ve UvrB) hasarlı ipliği keser. Oluşan 24-32 baz uzunluğundaki tek iplik boşluğu DNA polimeraz ile eşlenik ipliğine göre sentezlenir ve ligaz ile uçlar yapıştırılır (Şekil 3).
DNA Onarımını Etkileyen Faktörler
Farelerde in vivo ve laboratuvar ortamında in vitro yapılan çalışmalarda biyolojik ritim (Diurnal veya Sirkadyan ritim) ve bazı besinlerin DNA onarım yolaklarındaki bazı proteinler üzerine etkileri gösterilmiştir. Yine Aziz Sancar ve arkadaşları NER yolağınının önemli bileşenlerinden XPA proteininin farelerde saat 16:00-17:00 civarında arttığını, sabahları ise düşük düzeylerde olduğunu saptamışlar ve fareler sabah 5:00-9:00 arası UV maruz bırakıldığında akşam üstüne göre daha fazla invazif karsinom geliştiğini gözlemlemişlerdir. Ahududu XPA dahil bazı NER proteinlerini; enginar, deve dikeni, zerdeçal direk onarımda rol oynayan metil-guanin-DNA metil transferaz (MGMT) enzimini; yaban mersini, kahve, ayçiçeği çekirdeği, enginar tek iplik kırıklarına tanıyan PARP’ı; kahve, kızılcık, havuç yanlış eşleşmeyi düzelten onarım mekanizma proteinlerinden PMS2’yi; zeytin ve metaboliği kafeik asid, çukolatadaki proanthocyanidin’ler PARP ve PMS2’yi artırmaktadır. Yeşil çaydaki epigalocatechin-3-gallate MGMT ve MLH1’yı; Soya’daki Genistein de MGMT’yi artırmaktadır.
Lipid peroksidasyon bileşikleri, arsenik, kadmiyum, safra asidi, ve oksidatif strese yol açan gama irradyasyon, benzo(a)pyrene ve nikel gibi diğer bir çok karsinojen ise çeşitli DNA onarım mekanizması proteinlerini baskılamaktadır.
DNA Onarım Mekanizmasındaki Bozukluktan Kaynaklanan Hastalıklar
DNA onarım mekanizması ile düzeltilemeyen hataların hücrelerde birikimi kanser veya yaşlanma ile sonuçlanır (Şekil 4). DNA yanlış eşleşme onarım mekanizmasında rol oynayan enzimleri kodlayan genlerdeki (MLH1, MSH2, PMS2 ve MSH6) mutasyonlar kalıtsal non-polipozis kolorektal kansere; NER sisteminde rol oynayan enzimleri kodlayan genlerdeki (XP’ler) mutasyonlar Kseroderma pigmentozum denilen ultraviyoleye aşırı hassasiyeti olan, deri kanserine ve santral sinir sistemi kanserlerine yatkınlıkla seyreden hastalıklara yol açmaktadır. Çift iplik kırıkları sonucu aktiflenen ve DNA hasar cevabını başlatan ATM proteininde mutasyon sonucu Ataxia Telenjiaktezi hastalığı gelişmektedir. Ataxia Telenjiektazi hastalığında lösemi, lenfoma ve meme kanseri riski yüksektir. DNA’da oluşan çapraz bağları tanıyıp, çift iplik kırığı oluşturarak homolog rekombinasyon ile onarmak için gerekli olan FANC proteinlerinde mutasyonlar sonucu kemik iliği yetmezliği, lösemi ve baş-boyun kanserleri gibi solid tümörlerle sonuçlanan Fanconi anemisi kalıtsal hastalığı oluşur. Homolog rekombinasyonda rol oynayan BRCA1 ve BRCA2 mutasyonları kalıtsal meme ve yumurtalık (over) kanserlerine yol açmaktadır. Mutasyonlara ilaveten, DNA dizisini bozmayan ama gen ifadesini değiştiren epigenetik modifikasyonlar ile de DNA onarım sistemlerinin fonksiyonu bozularak kanser oluşabilmektedir. Özellikle direk onarımda rol oynayan metil-guanin-DNA metil transferaz (MGMT) genindeki epigenetik değişimler ile fonksiyon kaybı akciğer, beyin ve mide gibi çeşitli kanser olgularında saptanmaktadır.
DNA Onarım Mekanizmaları ve Kanser Tedavisinde Direnç
Normal hücrenin korunması için çok önemli olan DNA onarım mekanizmaları kanser geliştikten kanser hücrelerine avantaj sağlayabilmekte ve, kemoterapiye veya radyoterapiye direnç gelişmesine sebep olabilmektedir. Örneğin, kemoterapide kullanılan Temozolomid gibi alkilleyici ajanların kanser hücrelerinde oluşturduğu baz hasarlarını MGMT onararak iplik kırılmalarını önler ve dirence yol açar. Melanoma, pankreatik karsinoma ve glioma gibi tedaviye dirençli kanserlerde artmış MGMT düzeyleri saptanmıştır. Prokarbazin gibi bazları metilleyen kemoterapi ajanları ise yanlış eşleşmelere yol açarak DNA hasarına yol açtığı için MMR sistemi ile onarılır. MMR yeni sentezlenen DNA’yı hedeflediğinden ve metilleyici ajan ile oluşan hasar ise eski DNA’da olduğundan MMR aktivasyonu metillenmiş bazı onaramaz ve hücre sürekli MMR aktivasyon kısır döngüsüne girer. Bu kısır döngü ise programlı hücre ölümünün devreye girmesine yol açar. Dolayısıyla metilleyici kemoterapik ajanın etkili olabilmesi için sağlam bir MMR sistemine ihtiyaç vardır. Dolayısı ile, MMR fonksiyon kaybının olduğu kanserler bu tip kemoterapötik ajanlara dirençli olabilmektedir. BER sisteminin major AP endonukleazı APEX1’in artmış ifadesi de yumurtalık (over), prostat kanserleri, osteosarkom gibi çeşitli kanserlerde kemoterapötik dirence sebep olmaktadır. Cisplatin gibi platinyum tabanlı bileşiklerin oluşturduğu DNA lezyonları ise NER sistemi ile onarılmaktadır. ERCC1 ve XPF artmış gen ifadeleri cisplatine dirençli yumurtalık kanserlerinde saptanmıştır. Bu dirençli hücrelerde ERCC1 ve XPF gen susturma çalışmaları cisplatin duyarlılığın geri kazanıldığını göstermiştir.
DNA hasar ve onarımının kanser gelişimi üzerine etkilerini araştıran çalışmalar daha iyi kanser tedavi ilaçları geliştirmek ve kansere karşı önlemler almak için çok önemlidir. Örneğin sadece sigara DNA hasar kaynaklarından uzak durmak kanser insidansını azaltabilmeltedir. DNA onarımını artırmak veya en azından onarımı azaltan dış faktörlerden sakınmak da kanseri önlemek için faydalı olabilir. DNA hasarını yol açan faktörler hakkındaki bilgi birikimi oldukça fazla olmasına rağmen DNA onarımını artıran faktörler hakkındaki bilgiler henüz çok fazla değildir. DNA onarım mekanizmaları ile genom kararlılığı ve hücre döngüsü arasındaki ilişki de henüz tam olarak aydınlatılmamıştır. Ayrıca, kanser hücrelerinin kompanse edici DNA onarım sistemleri ile kemoterapotik ajanlar etkisiz kalabilmektedir. DNA onarımı ve genom kararlılığı arasındaki mekanistik ilişkiler ile ilgili bilgi birikiminin artmasıyla kanserde yeni tedavi hedeflerinin geliştirilmesi mümkün olacaktır. Örneğin, DNA onarım inhibitörlerinin kliniğe girmesi ile kemoterapi ajanlarının etkinliği artabilecektir. Bu ajanların sadece tümor hücrelerini hedeflemesi, DNA onarım inhibisyonundan kaynaklanacak toksik yan etkilerin azaltılması için önemlidir.
Ayşen Günel-Özcan ve Emin Kansu
Hacettepe Üniversitesi
Sağlık Bilimleri Enstitüsü
Kök Hücre Bilimleri Anabilim Dalı
agozcan@hacettepe.edu.tr; eminkansu47@gmail.com
Kaynakça
- Ames, BN., Shigenaga, MK., Hagen, TM. “Oxidants, antioxidants, and the degenerative diseases of aging”. Proc Natl Acad Sci U S A, 90 (17): 7915-7922, 1993.
- Bernstein, H., Crowley-Skillicorn, C., Bernstein, C., Payne, CM., Dvorak, K., Garewal, H. “Dietary Compouns That Enhance DNA Repair and their Relevance to Cancer and Aging”. In: BR Landseer (ed.) New Research on DNA Repair. New York: Nova Science Publishers, Inc; 99-113, 2007.
- Friedberg, EC. “How nucleotide excision repair protects against cancer”. Nat Rev. Cancer1: 22-33, 2001
- Helleday, T., Petermann, E., Lundin, C., Hodgson, B., Sharma, RA. “DNA repair pathways as targets for cancer therapy”. Nat Rev. Cancer, 8: 193-204, 2008.
- Lindahl, T. “DNA glycosylases, endonucleases for apurinic/apyrimidinic sites, and base excision-repair”. Prog Nucleic Acid Res Mol Biol. 22:135-192, 1979.
- Su, SS., Modrich, P. "Escherichia coli mutS-encoded protein binds to mismatched DNA base pairs.".Proceedings of the National Academy of Sciences of the United States of America. PNAS. 83 (14): 5057–5061, 1986.
- Sancar, A. Mechanisms of DNA excision repair. 23; 266 (5193):1954-1956, 1994.
- Sancar, A.,Lindsey-Boltz, LA., Gaddameedhi, S., Selby, CP., Ye, R., Chiou, YY., Kemp, MG., Hu, J., Lee, JH., Ozturk, N. “Circadian clock, cancer, and chemotherapy”. 54(2):110-123, 2015.
- http://dnapittcrew.upmc.com/db/orthologs.php
- http://sciencepark.mdanderson.org/labs/wood/fna_repair_genes.html
- DeVita, Jr. V, Lawrence, TS., Rosenberg, SA. “Primer of the Molecular Biology of Cancer”, in Cancer Principles and Practice of Oncology.Wolters Kluwer ed,
GÖRSEL MALZEMELER
TABLO-1

TABLO - 2. DNA Onarım Mekanizmaları



ŞEKİL - 1. a) Prof.Dr.Aziz Sancar İsveç’in başkenti Stockholm’de düzenlenen törende 2015 Nobel Kimya Ödülü’nü İsveç Kralı XVI. Carl Gustaf’ın elinden alırken (10 Aralık 2015). b) PTT tarafından hazırlanan ve satışa sunulan “2015 Nobel Kimya Ödülü Prof.Dr.Aziz Sancar” konulu Anma Pulu.

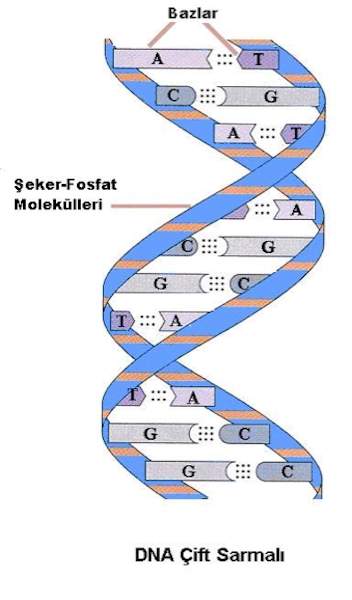
ŞEKİL - 2. DNA’nın temel yapısı
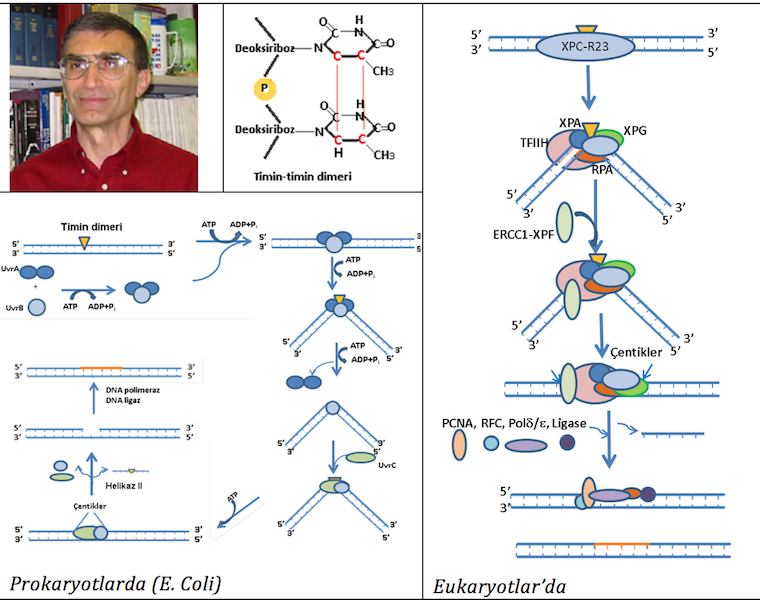
ŞEKİL -3. Prof.Dr. Aziz Sancar’ın DNA Onarım Mekanizmaları’na Katkısı:
Nukleotid kesimi ile onarım mekanizması
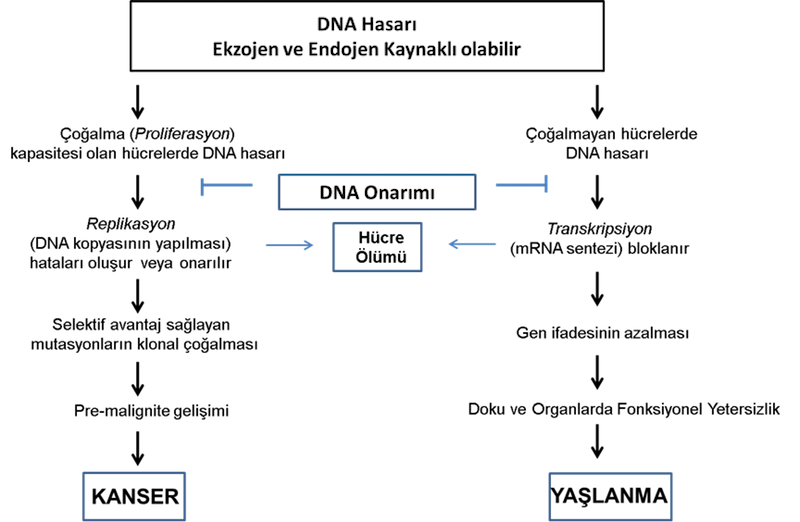
ŞEKİL - 4. DNA hasarı ve sonuçları